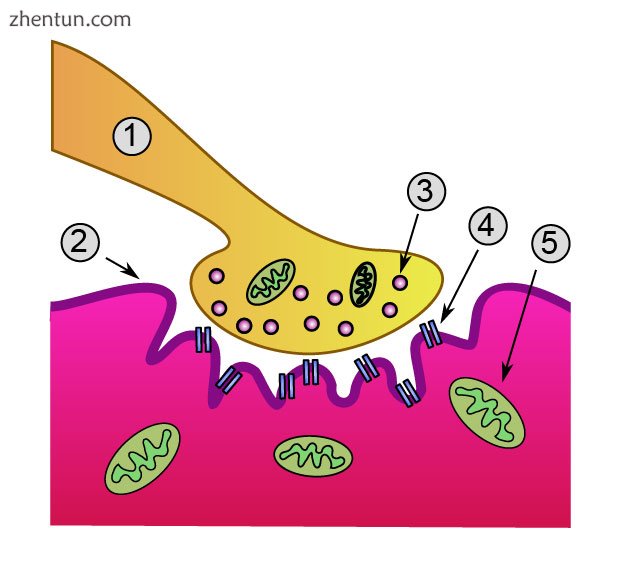
神经肌肉接头的全局视图:
1.轴突
2.运动终板
3.肌肉纤维
4.肌原纤维
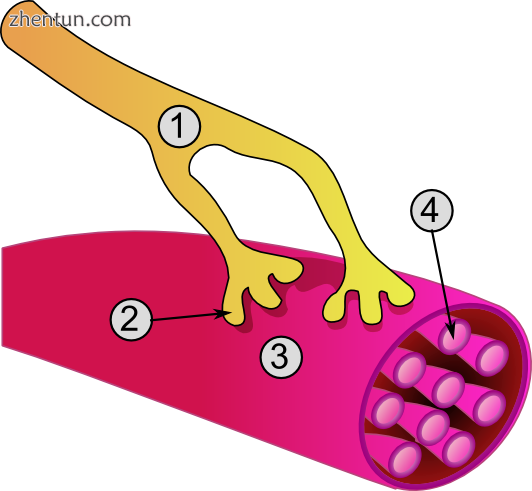
神经肌肉接头的详细视图:
1.突触前终端
2.肌纤维膜
3.突触小泡
4.烟碱乙酰胆碱受体
5.线粒体
神经肌肉阻滞药阻断神经肌肉接头的神经肌肉传导,[1]导致受影响的骨骼肌麻痹。这可以通过抑制乙酰胆碱(ACh)合成或释放或通过突触后作用于运动神经末端板的乙酰胆碱受体来预先突触来实现。虽然一些药物具有突触前的作用(如肉毒杆菌毒素和破伤风毒素),但目前临床重要性的药物突然发挥作用。
在临床使用中,神经肌肉阻滞用于辅助麻醉以产生麻痹,首先使声带麻痹,并允许气管插管,其次通过抑制自发通气来优化手术区域,并引起骨骼肌松弛。因为适当剂量的神经肌肉阻滞药物可使呼吸所需的肌肉麻痹(即隔膜),所以应该有机械通气来维持足够的呼吸。
即使发生完全传导阻滞,患者仍然意识到疼痛;因此,还必须给予全身麻醉剂和/或镇痛剂以防止麻醉意识。
季铵肌松弛剂是季铵盐,用作肌肉松弛的药物,最常用于麻醉。在外科手术期间必须防止肌肉的自发运动。肌肉松弛剂通过阻断烟碱乙酰胆碱受体来抑制神经元向肌肉的传递。它们的共同点是,它们的作用是必需的,是季铵基团的结构存在,通常是两个。其中一些是在自然界中发现的,另一些是合成分子。[2] [3]
目录
1 命名
2 分类
2.1 非去极化阻断剂
2.2 去极化阻断剂
2.3 药物比较
3 行动机制
4 结构和构象作用关系
4.1 分子长度和刚性
4.2 比尔斯与赖克定律
4.3 理性设计
4.4 效力
5 药代动力学
6 不利影响
7 估计效果
8 逆转
9 历史
10 参考资料
命名法
神经肌肉阻滞药物通常分为两大类:
Pachycurares,是具有非去极化活性的庞大分子
Leptocurares,是薄且柔韧的分子,往往具有去极化活性。[3]
基于它们的化学结构对它们进行分类也是常见的。
乙酰胆碱,suxamethonium和decamethonium
Suxamethonium是通过连接两个乙酰胆碱分子合成的,并且在甲鎓头之间具有与decamethonium相同数量的重原子。就像乙酰胆碱,琥珀胆碱,癸二烯和其他聚亚甲基链一样,具有适当长度和两个甲鎓,头部具有小的三甲基鎓头和柔性连接。他们都展示了去极化块。
氨基类固醇
主要文章:Aminosteroid
Pancuronium,维库溴铵,罗库溴铵,rapacuronium,dacuronium,malouètine,duador,dipyrandium,pipecuronium,chandonium(HS-310),HS-342和其他HS-化合物是氨基甾体药物。它们具有共同的类固醇结构基础,其提供刚性和庞大的主体。此类别中的大多数代理也将被归类为非去极化。
四氢异喹啉衍生物
基于四氢异喹啉部分的化合物如阿曲库铵,mivacurium和doxacurium将属于这一类。它们在鎓头之间具有长而柔韧的链,除了mivacurium的双键。 D-筒箭毒碱和二甲基tubocurarine也属于这一类。此类别中的大多数代理将被归类为非去极化。
Gallamine和其他化学类
Gallamine是一种三季铵,其中三个钍头通过醚键与苯环连接。许多其他不同的结构已被用于其肌肉松弛效应,例如葫芦(alloferin),anatruxonium,diadonium,fazadinium(AH8165)和tropeinium。
新型NMB试剂
近年来,许多研究致力于新型的季铵肌肉松弛剂。这些是不对称的二酯异喹啉化合物和双苄基哌嗪化合物,它们是各种二酸的双膦酸盐。这些课程的开发旨在创造更快,更短的肌肉松弛剂。二酯基异喹啉化合物的不对称结构和双苄基鎓上的酰氧基化苄基都使它们不稳定并且可能导致自发分解,因此可能起作用的持续时间较短。[4]
分类
这些药物分为两组:
非去极化阻断剂:这些药物构成临床相关的神经肌肉阻滞剂的大多数。它们通过竞争性阻断ACh与其受体的结合起作用,并且在某些情况下,它们还直接阻断ACh受体的离子活性。[5]
去极化阻断剂:这些药物通过使骨骼肌纤维的肌纤维去极化来起作用。这种持续的去极化使肌纤维抵抗ACh的进一步刺激。
非去极化阻断剂
神经肌肉非去极化剂是一种神经肌肉阻滞剂,不会使运动终板去极化。[6]
季铵肌松弛剂属于这一类。
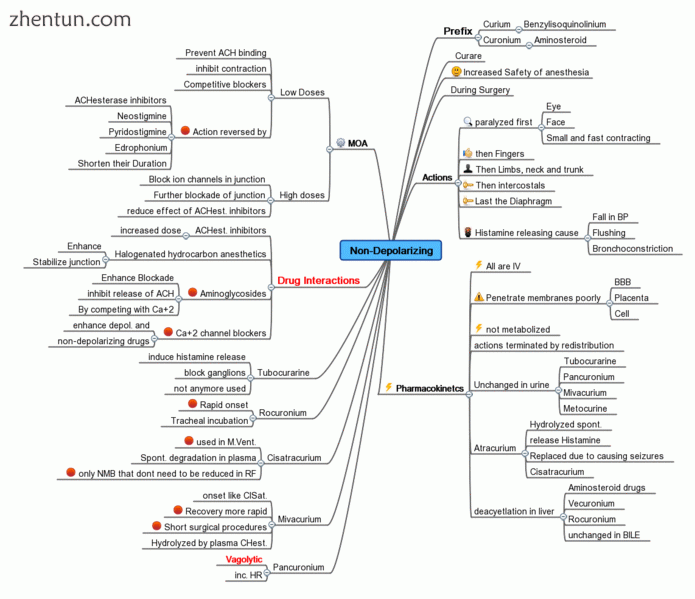
思维导图显示神经肌肉非去极化剂的总结
以下是一些更常见的药剂,它们在突触后乙酰胆碱受体位点作为抗乙酰胆碱的竞争性拮抗剂。
Tubocurarine,在南美植物Pareira,Chondrodendron tomentosum的curare中发现,是典型的非去极化神经肌肉阻滞剂。它起效缓慢(> 5分钟)和持续时间长(30分钟)。副作用包括低血压,其部分原因是其增加组胺释放的作用,血管扩张剂[7]以及阻断自主神经节的作用[8]。它在尿液中排出体外。
该药需要阻断约70-80%的ACh受体,使神经肌肉传导失效,从而有效阻断。在此阶段,仍然可以检测到终板电位(EPP),但是太小而不能达到激活肌纤维收缩所需的阈值电位。
非去极化神经肌肉阻滞剂的比较
非冷藏
去极化阻断剂
去极化神经肌肉阻滞剂是神经肌肉阻滞剂的一种形式,它使运动终板去极化。[10]
一个例子是琥珀胆碱。
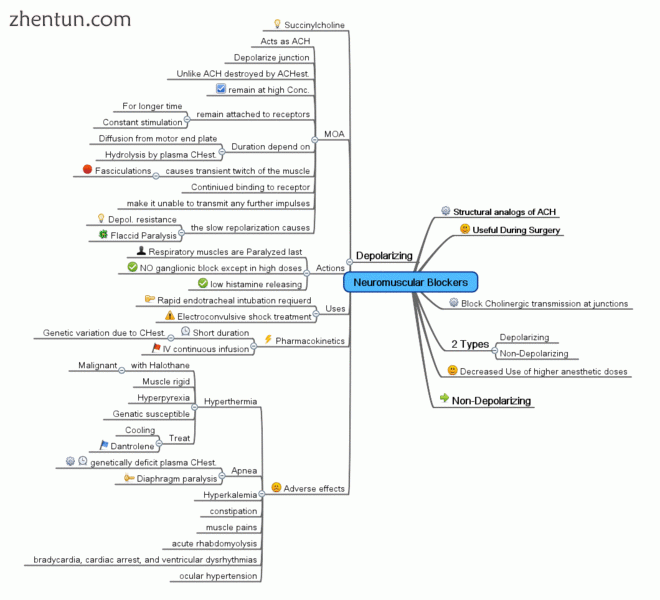
思维导图显示神经肌肉去极化剂的总结
去极化阻断剂通过使肌纤维的质膜去极化起作用,类似于乙酰胆碱。然而,这些试剂更能抵抗乙酰胆碱酯酶的降解,乙酰胆碱酯酶是负责降解乙酰胆碱的酶,因此可以更持久地使肌纤维去极化。这与乙酰胆碱不同,乙酰胆碱迅速降解并且仅短暂地使肌肉去极化。
去极化块有两个阶段。在阶段I(去极化阶段)期间,当它们使肌纤维去极化时,它们引起肌肉震颤(肌肉抽搐)。最终,在发生足够的去极化后,II期(脱敏阶段)进入并且肌肉不再对运动神经元释放的乙酰胆碱有反应。此时,已经实现了完整的神经肌肉阻滞。
原型去极化阻断药物是琥珀胆碱(suxamethonium)。它是临床上唯一使用的此类药物。由于各种胆碱酯酶(例如血液中的丁酰胆碱酯酶)的水解,它具有快速起效(30秒)但作用持续时间非常短(5-10分钟)。琥珀胆碱最初被称为二乙酰胆碱,因为它在结构上由与甲基连接的两个乙酰胆碱分子组成。 Decamethonium有时但很少用于临床实践。
药物比较
主要区别在于逆转这两种类型的神经肌肉阻滞药物。
非去极化阻滞剂被乙酰胆碱酯酶抑制剂药物逆转,因为非去极化阻滞剂是ACh受体的竞争性拮抗剂,因此可以通过ACh的增加来逆转。
去极化阻滞剂已经具有类似ACh的作用,因此这些药物在乙酰胆碱酯酶抑制剂的影响下具有延长的作用。去极化阻滞剂的施用最初产生肌束震颤(在麻痹发生之前突然抽搐)。这是由于肌肉的去极化。此外,术后疼痛与去极化阻滞剂有关。
强直衰弱是肌肉在足够高的电刺激频率下维持融合的手足抽搐的失败。
非去极化阻滞剂对患者有这种作用,可能是由于对突触前受体的影响。[11]
去极化阻滞剂不会导致强直性褪色。 然而,在重复剂量的琥珀胆碱中发生称为II期阻滞的临床相似表现。
这种差异在一种未知的神经肌肉阻滞药物中毒的情况下在诊断上是有用的。[11]
行动机制
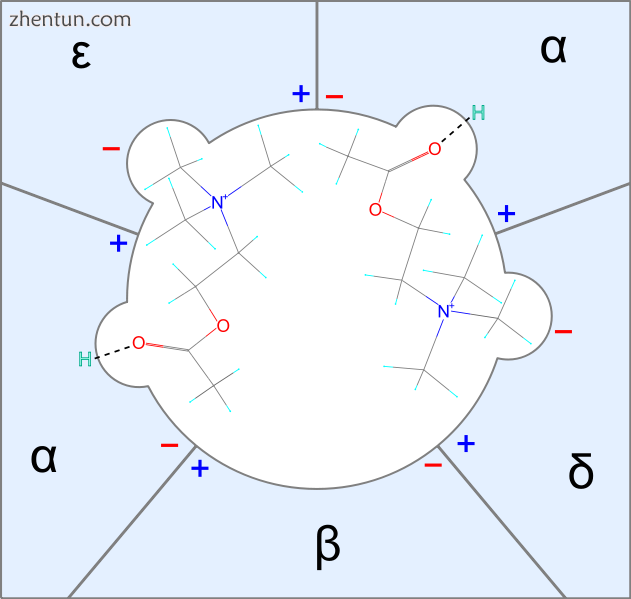
图1两个乙酰胆碱分子如何与烟碱受体上的接受位点结合的简单说明
第四纪肌肉松弛剂与烟碱乙酰胆碱受体结合并抑制或干扰ACh与受体的结合和作用。每个ACh-受体具有两个接受位点,并且受体的活化需要与它们两者结合。每个受体位点位于受体的两个α-亚基之一。每个接收位点都有两个亚位点,一个与阳离子铵头结合的阴离子位点和一个通过提供氢键与封闭剂结合的位点。[3]
非去极化剂乙酰胆碱结合的减少导致其效果降低,并且不太可能发生神经元向肌肉的传递。通常认为非去极化剂通过充当可逆竞争性抑制剂而阻断。也就是说,它们作为拮抗剂与受体结合,并且留下更少的可用于乙酰胆碱结合的受体。[3] [12]
去极化剂去极化剂通过结合并激活ACh受体产生其阻断,首先引起肌肉收缩,然后麻痹。它们与受体结合并通过像乙酰胆碱那样打开通道引起去极化。这导致重复激发持续比正常乙酰胆碱激发更长,并且很可能通过去极化剂对酶乙酰胆碱酯酶的抗性来解释。恒定的去极化和触发受体使终板对乙酰胆碱的活化具有抗性。因此,正常神经元向肌肉的传递不会引起肌肉收缩,因为终板是去极化的,因此肌肉瘫痪。[3] [12]
与烟碱受体结合较短的分子如乙酰胆碱需要两个分子来激活受体,每个接受部位一个。 Decamethonium同源物更喜欢直线构象(它们的最低能量状态),通常跨越两个具有一个分子(结合位点间)的接受位点。在安装接收部位时,较长的同类物必须弯曲。
分子需要弯曲和适合的能量越大,通常会导致效力降低。[13]
结构和构象行为的关系
神经肌肉阻滞药物的构象研究相对较新且正在发展。传统的SAR研究没有指定分子的环境因素。基于计算机的构象搜索假设分子在真空中,而在体内不是这种情况。溶剂化模型考虑了溶剂对分子构象的影响。然而,没有溶剂化系统可以模拟身体复杂的液体成分的影响。[14]
将肌肉松弛剂分为刚性和非刚性最多是定性的。构象变化所需的能量可以提供更精确和定量的图像。在较长的肌肉松弛链中减少胫骨头距离所需的能量可以量化它们弯曲和适合其接受部位的能力。[13]使用计算机可以计算出最低能量状态的构象异构体,从而最多地填充并最好地代表分子。该状态称为全局最小值。一些简单分子的全局最小值可以很容易地确定地发现。如对于decamethonium,直线构象显然是最低能量状态。另一方面,一些分子具有许多可旋转的键,它们的全局最小值只能近似。[14]
分子长度和刚性
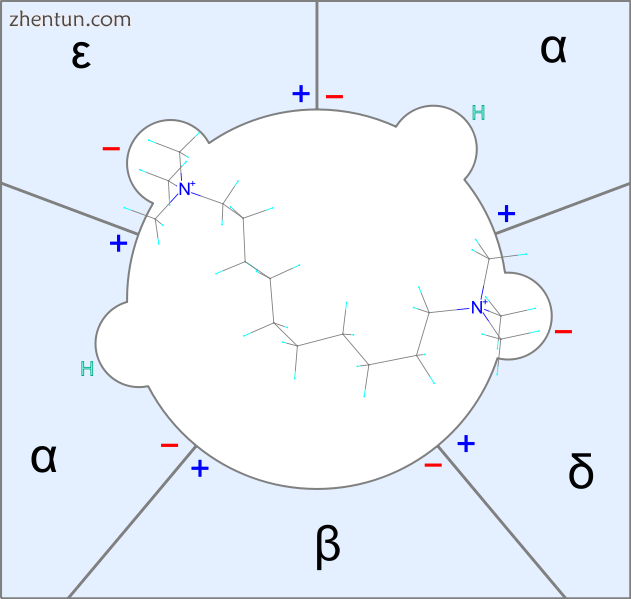
图2癸二酮如何与烟碱受体结合的简单说明。鎓头与离子通道的两个独立的亚基结合
神经肌肉阻滞剂需要适合接近2纳米的空间,这类似于十甲铵的分子长度。[13]一些十甲铵同源物分子可能仅与一个接受位点结合。灵活的分子更有可能拟合接受部位。然而,人口最多的构造可能不是最适合的构造。事实上,非常灵活的分子是具有平坦剂量 - 反应曲线的弱神经肌肉抑制剂。另一方面,刚性或刚性分子倾向于适合或根本不适合。如果最低能量构象适合,则该化合物具有高效力,因为存在接近最低能量构象的大量分子。分子可以很薄但很坚硬。[14]例如,十甲铵需要相对较高的能量来改变N-N距离。[13]
通常,分子刚性有助于效力,而大小影响肌肉松弛剂是否显示极化或去极化效果。[4]阳离子必须能够流过离子通道的跨膜管以使终板去极化。[14]小分子可能是刚性的和有效的,但不能占据或阻挡接收部位之间的区域。[4]另一方面,大分子可以与两个接受位点结合并阻碍去极化阳离子,而与下面的离子通道是打开还是关闭无关。具有指向突触的亲脂性表面通过排斥阳离子来增强这种效果。这种效应的重要性在不同的肌肉松弛剂之间变化,并且从非去极化块分类去极化是一个复杂的问题。氦头通常保持较小,连接头的链通常保持N-N距离为10N或O原子。保持距离链的结构可以变化(双键,环己基,苄基等)[14]
琥珀胆碱在其N原子之间具有10个原子的距离,如十甲铵。然而据报道,与乙酰胆碱一样,需要两个分子才能打开一个烟碱离子通道。对此的构象解释是琥珀胆碱的每个乙酰胆碱部分优选为高密度(弯曲,顺式)状态。 N和O原子之间的吸引力大于鎓头部的排斥力。在这个人口最多的州,N-N距离比十个碳原子的最佳距离短,而且太短而不能占据两个接收点。琥珀酰和乙酰胆碱之间的这种相似性也解释了它的乙酰胆碱样副作用。[14]比较分子长度,pachycurares dimethyltubocurarine和d-tubocurarine都非常坚硬,总长度接近1.8 nm。泮库溴铵和维库溴铵测量为1.9nm,而哌啶铵为2.1nm。这些化合物的效力遵循与其长度相同的等级。同样,leptocurares喜欢类似的长度。测量2 nm的Decamethonium是同类产品中最有效的,而C11则略长。尽管具有较低的体积和刚度,但是Gallamine在同类产品中效果最强,其测量范围为1.9 nm。[4] [13]基于这些信息,可以得出结论,神经肌肉阻滞剂的最佳长度,去极化与否,应为2至2.1 nm。[14]
长链双季四氢异喹啉如阿曲库铵,顺式阿曲库铵,mivacurium和doxacurium的CAR很难确定,因为它们具有庞大的鎓头和大量可旋转的键和基团。这些代理必须遵循与其他代理相同的接受拓扑,这意味着它们在不弯曲的情况下不适合接收站点。[13]例如,Mivacurium在拉伸时具有3.6nm的分子长度,远离2至2.1nm的最佳值。即使弯曲,Mivacurium,atracurium和doxacurium也具有比d-tubocurarine更大的N-N距离和分子长度。为了使它们合身,它们具有灵活的连接,使其头部有机会有利地定位自己。这种弯曲的N-N情景可能不适用于喜欢直构型的laudexium和decamethylene bisatropium。[14]
比尔斯与赖克定律
已经得出结论,当与烟碱受体结合时,乙酰胆碱和相关化合物必须处于高密度(弯曲)状态。[15] Beers和Reich在1970年对胆碱能受体的研究显示了影响化合物是毒蕈碱还是烟碱的关系。他们表明,从第四个N原子的中心到相应的O原子(或等价的H-键受体)的范德华延伸的距离是一个决定因素。如果距离为0.44 nm,则该化合物显示出毒蕈碱性质 - 如果距离为0.59 nm,则烟碱性质占主导地位。[16])
理性设计
潘库溴铵仍然是结构 - 作用/效应关系数据逻辑和合理设计的为数不多的肌肉松弛剂之一。选择类固醇骨架是因为它具有合适的尺寸和刚性。插入乙酰胆碱部分以增加受体亲和力。尽管有许多不必要的副作用,起效缓慢和恢复速度,但它是一个巨大的成功,当时是最有效的神经肌肉药物。泮库溴铵和一些其他神经肌肉阻滞剂阻断M2受体,因此影响迷走神经,导致低血压和心动过速。这种毒蕈碱阻断作用与泮库溴铵上A环上的乙酰胆碱部分有关。使A环上的N原子三级化,环失去其乙酰胆碱部分,并且所得化合物维库溴铵对毒蕈碱受体的亲和力几乎低100倍,同时保持其烟碱亲和力和相似的作用持续时间。因此,维库溴铵不会产生心血管疾病。[3] D环显示出优异的性能,可以高精度地验证Beers和Reich的规则。因此,维库溴铵具有所有单季铵化合物的最大效力和特异性。[14]
效力
两个官能团显着促进了氨基甾体神经肌肉阻滞效力,推测它们能够在两个点上结合受体。 A和D-环(结合位点间)或D-环乙酰胆碱部分(在位点内的两点处结合)上的双 - 四元两点排列最有可能成功。第三组可能会产生不同的影响。[14]哌嗪的A和D环上的季铵基和乙酰基阻止其在部位内结合(结合到相同位点的两个点)。相反,它必须绑定为bis-quaternary(站点间)。[4]这些结构与乙酰胆碱和与乙酰胆碱部分相关的烟碱或毒蕈碱副作用的游离哌啶鎓非常不同。此外,它们保护分子免受胆碱酯酶的水解,这解释了其排泄肾脏的性质。季铵原子上的四个甲基使其比大多数氨基甾类具有更低的亲脂性。这也通过抵抗肝摄取,代谢和胆汁排泄而影响哌嗪的代谢。分子的长度(2.1纳米,接近理想值)及其刚性使哌嗪成为最有效和清洁的单体双季。尽管NN距离(1.6 nm)远离理想的距离,但它的鎓头部暴露良好,并且四元基团有助于将鎓头部聚集到受体的阴离子中心而没有手性问题。[14 ]
一般添加两个以上的头部不会增加效力。尽管在三聚氰胺中的第三个鎓头似乎有助于将两个外部头部定位在接近最佳分子长度的位置,但是它可能会干扰不利,并且像所有多元化合物一样,聚胺胺变成弱肌肉松弛剂。考虑到乙酰胆碱,大于甲基的季铵化基团和大于乙酰基的酰基会降低分子的效力。带电的N和羰基O原子与它们在接收位点上结合的结构间隔开,因此降低了效力。例如,维库溴铵中的羰基O被向外推,以接近接收部位的H-键供体。这也有助于解释为什么gallamine,rocuronium和rapacuronium的效力相对较低。[14]通常,甲基季铵化对于效力是最佳的,但是,与此规则相反,gallamine的三甲基衍生物具有比gallamine更低的效力。其原因是,没食子胺具有不理想的N-N距离。用甲基取代乙基将使分子长度也短于最佳。四氢异喹啉试剂的甲氧基化似乎改善了它们的效力。甲氧基化如何提高效力仍不清楚。组胺释放是苄基异喹啉肌肉松弛剂的常见属性。该问题通常随着效力和剂量的增加而降低。需要更大剂量会增加这种副作用的程度。组胺释放的构象或结构解释尚不清楚。[14]
药代动力学
代谢和霍夫曼消除
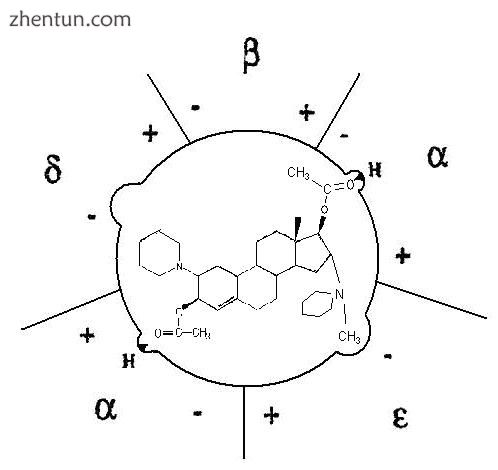
图3维库溴铵如何与烟碱受体结合的简单说明。它的D环在两点与受体结合,分子的亲脂侧排斥阳离子流过离子通道
维库溴铵在3位去乙酰化导致非常活跃的代谢物。[17]在rapacuronium的情况下,3-脱酰基代谢物甚至比rapacuronium更有效。只要D-环乙酰胆碱部分不变,它们就能保持肌肉松弛效果。另一方面,在第17位脱合产生的单季铵类氨基甾体通常是弱肌肉松弛剂。[14]在阿曲库铵的开发中,主要思想是利用霍夫曼消除体内肌肉松弛剂。当使用双苄基 - 异喹啉类分子时,在分子中插入适当的特征,如适当的吸电子基团,霍夫曼消除应该在体内条件下进行。产生的分子阿曲库铵在体内自发分解为无活性化合物,尤其适用于肾脏或肝功能衰竭的患者。顺式阿曲库铵与阿曲库铵非常相似,只是它更有效并且导致组胺释放的趋势较弱。[3]
与发病时间的结构关系
除了发病时间与效力呈负相关外,结构对作用开始的影响尚不清楚。[18]通常,单季铵类氨基甾醇比双季铵化合物更快,这意味着它们也具有更低的效力。这种效应的可能解释是药物递送和受体结合具有不同的时间尺度。较大剂量的肌肉松弛剂较弱,因此中央隔室中的更多分子必须扩散到效应隔室中,该效应隔室是身体受体口腔内的空间。在递送到效应室后,所有分子都迅速起作用。[19]治疗上这种关系非常不方便,因为低效力,通常意味着低特异性可降低安全范围,从而增加副作用的机会。此外,尽管低效力通常会加速起效,但它并不能保证快速起效。例如,Gallamine是弱而缓慢的。当需要快速起效时,通常优选琥珀胆碱或罗库溴铵。[14]
消除
肌肉松弛剂可具有非常不同的代谢途径,并且如果某些消除途径不活跃,例如在肾衰竭中,则药物不会累积是重要的。
不利影响
由于这些药物可能导致隔膜瘫痪,因此应提供机械通气以提供呼吸。
此外,这些药物可能表现出心血管作用,因为它们对烟碱受体没有完全选择性,因此可能对毒蕈碱受体有影响。[8]如果自主神经节或肾上腺髓质的烟碱受体被阻断,这些药物可能会引起自主神经症状。此外,神经肌肉阻滞剂可能促进组胺释放,导致低血压,潮红和心动过速。
在对肌肉组织进行去极化时,六甲铵可能会引发肌纤维中大量钾的瞬时释放。这使患者面临危及生命的并发症的风险,例如高钾血症和心律失常。
某些药物如氨基糖苷类抗生素和多粘菌素以及一些氟喹诺酮类药物也具有神经肌肉阻滞作用,因为它们有副作用。[20]
估计效果
估计神经肌肉阻滞程度的方法包括对来自表面电极的刺激的肌肉反应的评估,例如在四轮测试中,其中四个这样的刺激快速连续地给出。没有神经肌肉阻滞,所产生的肌肉收缩具有相同的强度,但在神经肌肉阻滞的情况下逐渐减少。[21]建议在重症监护中使用连续输注神经肌肉阻滞剂。[22]
翻转
作为常用的实例,非去极化神经肌肉阻滞药物的作用可以用乙酰胆碱酯酶抑制剂,新斯的明和氯化腾喜龙(一种抗胆碱酯酶药)逆转。其中,氯化腾喜龙比新斯的明具有更快的起效,但当用于拮抗深部神经肌肉阻滞时,它是不可靠的。[23]乙酰胆碱酯酶抑制剂增加神经肌肉接头中乙酰胆碱的量,因此其作用的先决条件是神经肌肉阻滞不完全,因为如果每个乙酰胆碱受体被阻断,那么存在多少乙酰胆碱无关紧要。
Sugammadex是一种新型药物,用于在全身麻醉中通过罗库溴铵逆转神经肌肉阻滞。它是第一种选择性松弛剂结合剂(SRBA)。[24]
历史
Curare是来自Strychnos和Chondrodendron属的某些南美植物的粗提取物,最初由Walter Raleigh等探险家带到欧洲[25]。它在19世纪被称为具有麻痹作用,部分原因在于像克劳德伯纳德这样的科学家。[26] D-tubocurarine是一种单季铵生物碱,于1942年从Chondrodendron tomentosum中分离出来,并且它被证明是负责产生麻痹效应的curare的主要成分。那时,人们知道curare和因此d-tubocurarine在神经肌肉接头处起作用。筒箭毒素的分离及其作为药物Intocostrin的营销导致了神经肌肉阻滞药物领域的更多研究。科学家们发现,筒箭毒碱的效力与两个季铵头之间的分离距离有关[2] [27]。
进一步的研究导致合成分子的发展具有不同的curariform效应,这取决于季铵基团之间的距离。其中一个合成的双季铵化合物是十甲基二十四碳化合物。在对decamethonium进行研究后,科学家开发了suxamethonium,它是一种双乙酰胆碱分子,连接在乙酰端。 1957年,suxamethonium的发现和发展获得了诺贝尔医学奖.Sucamethonium表现出不同的阻滞效果,其效果更快,并在阻滞前增强肌肉反应。此外,已知tubocurarine效应可被乙酰胆碱酯酶抑制剂逆转,而decamethonium和suxamethonium阻滞是不可逆的。[2] [3]
从植物Malouetia bequaertiana中分离出另一种化合物malouétine,它是一种双季甾体,并显示出curariform活性。这导致了合成药物泮库溴铵,一种双季铵类固醇,以及其他具有更好药理学特性的药物。[2] [28]对这些分子的研究有助于提高对神经元和受体生理学的理解。
另见
Ganglionic blocker
参考
"Dorlands Medical Dictionary:neuromuscular blocking agent".
Raghavendra, T. (2002). "Neuromuscular blocking drugs: discovery and development". Journal of the Royal Society of Medicine. 95 (7): 363–367. doi:10.1258/jrsm.95.7.363. PMC 1279945. PMID 12091515.
W. C. Bowman (2006). "Neuromuscular block". British Journal of Pharmacology. 147 (S1): S277–S286. doi:10.1038/sj.bjp.0706404. PMC 1760749. PMID 16402115.
Lee, C. (2001). "Structure, conformation and action of neuromuscular blocking drugs". British Journal of Anaesthesia. 87 (5): 755–769. doi:10.1093/bja/87.5.755. PMID 11878528.
Bufler J, Wilhelm R, Parnas H, Franke C, Dudel J (1996). "Open channel and competitive block of the embryonic form of the nicotinic receptor of mouse myotubes by (+)-tubocurarine". J. Physiol. 495 (Pt 1): 83–95. doi:10.1113/jphysiol.1996.sp021575. PMC 1160726. PMID 8866353.
Neuromuscular+Nondepolarizing+Agents at the US National Library of Medicine Medical Subject Headings (MeSH)
Inada E, Philbin DM, Machaj V, et al. (1986). "Histamine antagonists and d-tubocurarine-induced hypotension in cardiac surgical patients". Clin. Pharmacol. Ther. 40 (5): 575–80. doi:10.1038/clpt.1986.226. PMID 2429800.
Ostergaard D, Engbaek J, Viby-Mogensen J (1989). "Adverse reactions and interactions of the neuromuscular blocking drugs". Medical Toxicology and Adverse Drug Experience. 4 (5): 351–68. doi:10.1007/bf03259917. PMID 2682131.
Rang, H. P. (2003). Pharmacology. Edinburgh: Churchill Livingstone. p. 151. ISBN 978-0-443-07145-4. OCLC 51622037.
Neuromuscular+Depolarizing+Agents at the US National Library of Medicine Medical Subject Headings (MeSH)
Flower, Rod; Rang, Humphrey P.; Dale, Maureen M.; Ritter, James M. (2007). Rang & Dale's pharmacology. Edinburgh: Churchill Livingstone. ISBN 978-0-443-06911-6.
Brunton LL, Lazo JS, Parker KL (2006). "Goodman & Gilman's The pahrmacological basis of Therapeutics". New York: McGraw-Hill. pp. 220–223. ISBN 0071624422.
Lee, C.; Jones, T. (2002). "Molecular conformation–activity relationship of decamethonium congeners". British Journal of Anaesthesia. 88 (5): 692–699. doi:10.1093/bja/88.5.692. PMID 12067008.
Lee, Chingmuh (2003). "Conformation, action and mechanism of action of neuromuscular blocking muscle relaxants". Pharmacology and Therapeutics. 98 (2): 143–169. doi:10.1016/S0163-7258(03)00030-5.
Spivak CE, Waters JA, Aronstam RS (1 July 1989). "Binding of semirigid nicotinic agonists to nicotinic and muscarinic receptors". Molecular Pharmacology. 36 (1): 177–184. PMID 2747625.
Beers, W.H; E. Reich (1970). "Structure and Activity of Acetylcholine". Nature. 228 (5275): 917–922. Bibcode:1970Natur.228..917B. doi:10.1038/228917a0.
Caldwell JE, Szenohradszky J, Segredo V, Wright PM, McLoughlin C, Sharma ML, Gruenke LD, Fisher DM, Miller RD (1 September 1994). "The pharmacodynamics and pharmacokinetics of the metabolite 3- desacetylvecuronium (ORG 7268) and its parent compound, vecuronium, in human volunteers". American Society for Pharmacology and Experimental Therapeutics. 270 (3): 1216–1222. PMID 7932174.
Kopman AF, Klewicka MM, Kopman DJ, Neuman GG (1999). "Molar potency is predictive of the speed of onset of neuromuscular block for agents of intermediate, short and ultrashort duration". Anesthesiology. 90 (2): 425–431. doi:10.1097/00000542-199902000-00016. PMID 9952148.
Donati, F.; Claude Meistelman (2005). "A kinetic-dynamic model to explain the relationship between high potency and slow onset time for neuromuscular blocking drugs". Journal of pharmacokinetics and Pharmacodynamics. 19 (5): 537–552. doi:10.1007/BF01062962. PMID 1783991.
Paradelis, A. G.; Triantaphyllidis, C.; Logaras, G. (1976). "Neuromuscular Blocking Activity of Aminoglycoside Antibiotics". Pharmacology of Antibiotics. p. 359. doi:10.1007/978-1-4684-3123-0_51. ISBN 978-1-4684-3125-4.
thefreedictionary.com > train-of-four Citing: Mosby's Medical Dictionary, 8th edition.
Strange, C.; Vaughan, L.; Franklin, C.; Johnson, J. I. M. (1997). "Comparison of Train-of-Four and Best Clinical Assessment during Continuous Paralysis". American Journal of Respiratory and Critical Care Medicine. 156 (5): 1556–1561. doi:10.1164/ajrccm.156.5.9701079. PMID 9372675.
Shorten, G. D.; Ali, H. H.; Goudsouzian, N. G. (1993). "Neostigmine and edrophonium antagonism of moderate neuromuscular block induced by pancuronium or tubocurarine". British Journal of Anaesthesia. 70 (2): 160–162. doi:10.1093/bja/70.2.160. PMID 8435259.
Naguib M (2007). "Sugammadex: another milestone in clinical neuromuscular pharmacology". Anesth Analg. 104 (3): 575–81. doi:10.1213/01.ane.0000244594.63318.fc. PMID 17312211.
Taylor, P. (1990). Goodman and Gilman's The Pharmacological Basis of Therapeutics, 8th ed. A. G. Gilman et al. (eds.). New York: Pergamon Press. p. 167. ISBN 0071052704.
Bernard, C (1857). "25th lesson". Leçons sur les effets des substances toxiques et médicamenteuses (in French). Paris: J.B. Baillière. pp. 369–80.
Nedergaard, O. A. (2003). "Curare: Flying death". Pharmacology & Toxicology. 92 (4): 154–5. doi:10.1034/j.1600-0773.2003.920402.x. PMID 12753415.
McKenzie, A. G. (2000). "Prelude to pancuronium and vecuronium". Anaesthesia. 55 (6): 551–556. doi:10.1046/j.1365-2044.2000.01423.x. PMID 10866718. |